Maladie d’Alzheimer : les multiples intérêts d’une prédiction personnalisée
Date:
Mis à jour le 20/03/2025
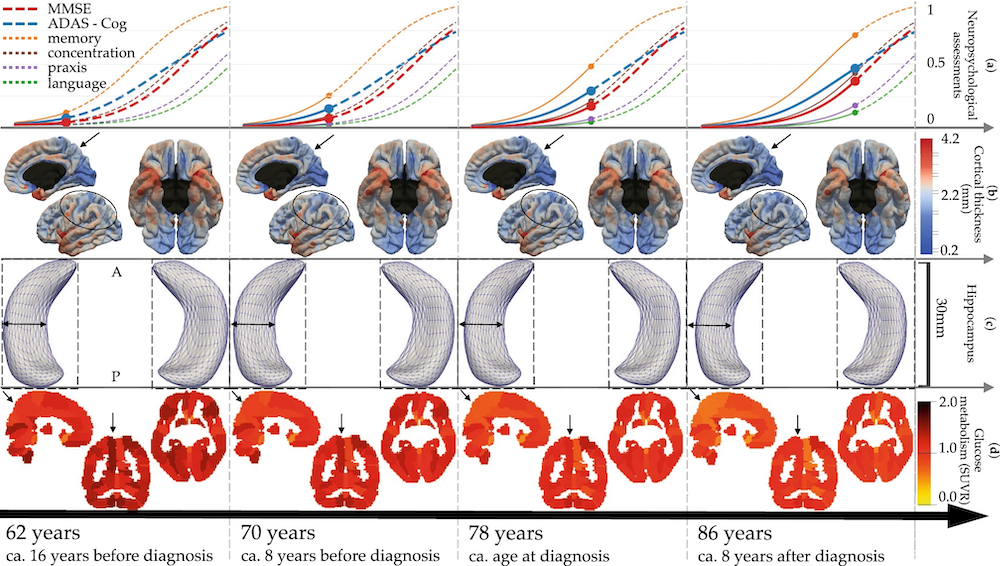
Modèles numériques personnalisables de l'évolution de la maladie d'Alzheimer présentés à quatre différents stades avec une estimation du temps écoulé en amont ou en aval du diagnostic. Les différentes images (du bas vers le haut) montrent l'altération du métabolisme du glucose dans le cerveau, l'atrophie de l'hippocampe, l'amincissement du cortex et l'apparition du déclin cognitif. Illustration issue de Scientific Report, 11, 8020 (2021).
Depuis une dizaine d’années, Stanley Durrleman et son équipe-projet Aramis, du Centre Inria de Paris – intégrée au sein de l'Institut du Cerveau (ICM) et commune avec le CNRS, l'Inserm et Sorbonne Université –, cherchent à prédire l’évolution du cerveau chez les personnes atteintes de maladies neurodégénératives… et ils y parviennent ! Ils ont en effet créé un modèle, nommé AD Course Map, qui allie géométrie et statistiques pour prévoir la trajectoire de patients en fonction de leurs données médicales de départ.
Des mises en situation ont prouvé son bon fonctionnement : des résultats d’imagerie et de tests cliniques ont été transmis à l’algorithme, qui a prédit alors l’évolution cognitive des patients et celle-ci s’est révélée proche de celle observée en réalité. AD Course Map a par ailleurs montré qu’il prédisait mieux le déclin cognitif que 56 autres méthodes alternatives lors du Tadpole challenge, organisé en 2019 par l’initiative européenne EuroPond (qui rassemble des scientifiques en neurosciences computationnelles et en neurologie clinique), en collaboration avec l’Alzheimer’s Disease Neuroimaging Initiative.
« Prédire, c’est bien, mais dans quel but finalement ? », pointe Stanley Durrleman. Selon le chercheur et son équipe, deux pistes sont à privilégier. La première : améliorer la prise en charge des patients en proposant par exemple un parcours de soin et un suivi adaptés à l’évolution prévue de la maladie.
La deuxième : aider la recherche pharmaceutique.
Très peu de médicaments sont mis sur le marché contre la maladie d’Alzheimer et l’une des raisons de ce phénomène est qu’il est difficile de juger de leur efficacité lors d’un essai clinique, explique le codirecteur d’Aramis. La maladie peut en effet rester stable pendant plusieurs années, donc le bénéfice d’une molécule risque d’être dilué lors d’un essai, puisque même dans le groupe placebo, il peut y avoir statistiquement peu d’évolution.
Toutefois, si un modèle permet de prédire quand les patients vont connaître un déclin cognitif, il est alors possible de n’inclure que de tels sujets dans l’essai… et de mesurer ainsi l’efficacité du traitement dans de bien meilleures conditions. C’est justement ce que vient de prouver l’équipe-projet Aramis à travers une étude dont les résultats ont été publiés dans Nature Communications.
Première étape de cette recherche : entraîner le modèle à partir des données médicales de 80 % des patients d’une cohorte nord-américaine présentant des biomarqueurs de la maladie d’Alzheimer, mais n’étant pas forcément diagnostiqués pour celle-ci. Les 20 % restants ont servi à tester la justesse des prédictions d’AD Course Map. Puis, le modèle a été appliqué à quatre autres cohortes, au Japon, en Europe et en Australie, soit en tout 4 687 patients, qui avaient été suivis pendant quatre ans.
La première bonne surprise : même si l’entraînement du modèle a concerné une population d’Amérique du Nord, les prédictions étaient aussi bonnes, voire meilleures, pour les autres populations, alors que la généralisation est plutôt rare en médecine, détaille Stanley Durrleman. Le second point positif est que le modèle n’est pas biaisé en fonction du genre : il prédit aussi bien la trajectoire chez les hommes que chez les femmes, alors que celle-ci est différente en général.
En outre, AD Course Map fait mieux qu’un autre modèle prédictif, RNN-AD, basé quant à lui sur le deep learning. « De telles méthodes de prédiction ont besoin d’énormément de données d’entrée pour découvrir les motifs cachés dans celles-ci, analyse le chercheur. Or, dans le cas de la maladie d’Alzheimer, les données, surtout celles qui s’étalent dans le temps, sont plutôt limitées : les patients sont rarement suivis plus de quelques années et les informations recueillies sont variables. En outre, le deep learning fonctionne bien pour de la classification or là, ce n’est pas une réponse binaire ni même tertiaire qu’il faut apporter, mais une prédiction personnalisée sur un temps relativement long. »
Le plus intéressant est surtout qu’AD Course Map a montré toute sa pertinence pour la sélection d’une cohorte d’essai clinique. En se basant sur les protocoles de six essais passés, l’équipe-projet Aramis a prouvé qu’il était possible de réduire de 38 à 50 % le nombre de patients nécessaires pour évaluer l’efficacité d’un traitement. « En ciblant directement les patients dont l’évolution correspond à celle que doit traiter le médicament, nous augmentons la puissance de l’essai, résume Stanley Durrleman. Les patients dans le groupe placebo vont en effet réellement évoluer, tandis que dans le groupe traité, l’effet de la molécule sera visible, ou non. »
Des résultats qui vont venir renforcer encore la collaboration d’Aramis avec les laboratoires pharmaceutiques. Ces derniers font en effet déjà appel à Inria pour étudier la possibilité de mettre le modèle en pratique dans leurs essais cliniques, ou pour observer rétrospectivement les résultats d’essais passés. Ce type de modèle a d’ailleurs le vent en poupe, en oncologie également par exemple, et l’agence européenne du médicament a même émis un avis favorable à leur utilisation pour la conception d’essais cliniques.
Dans les deux ans qui ont précédé nos travaux, la mise sur le marché d’un premier médicament contre Alzheimer a été acceptée par l’agence du médicament américaine… alors que l’efficacité de celui-ci au cours des essais cliniques était faible, poursuit Stanley Durrleman. Ceci a soulevé des questions, à juste titre, et il y a donc urgence à pouvoir mettre en place des essais cliniques qui évalueront mieux le bénéfice des molécules. D’une part, afin de ne pas ensuite traiter des patients pour rien, avec des effets secondaires parfois non négligeables et d’autre part, pour limiter les coûts imputés au système de santé.
Le chercheur avance en parallèle sur la deuxième application possible de son modèle : la prise en charge des patients. Il a créé en septembre dernier une startup destinée à mettre sur pied une clinique digitale, nommée "la Clinique du docteur Mémo", et accessible sur docteurmemo.fr Les personnes inquiètes quant à l’état de leur mémoire peuvent répondre à un questionnaire d’orientation rapide mis au point par des neurologues. En fonction de leurs résultats, elles seront soit rassurées, soit orientées vers une consultation avec un médecin spécialement formé à la prise en charge de ces troubles cognitifs.
En se basant sur AD Course Map, ce dernier pourra ensuite proposer un suivi pertinent. « Le patient qui devrait rester stable un bon moment se verra par exemple proposer des jeux de renforcement cognitifs à faire à la maison, tandis que celui pour lequel l’algorithme prédit un déclin plus rapide pourra bénéficier d’une prise en charge médicale et d’un suivi plus fréquent », illustre Stanley Durrleman.
Le point clé de la démarche ? Permettre aux patients d’accéder à un médecin spécialisé au stade précoce de la maladie. « Nous savons qu’il faut diagnostiquer tôt, mais les médecins généralistes sont peu formés à cette réalité, reprend le scientifique. Or comment assurer une prise en charge précoce si le diagnostic est bloqué au premier maillon de la chaîne ? Avec notre clinique digitale, nous pourrons contourner cet obstacle. » Il reste à présent à la faire connaître au plus grand nombre…